

Acherontia atropos (Linnaeus, 1758)
Sphinx atropos Linnaeus, 1758, Syst. Nat. (Edn 10) 1: 490.
Localité type: Europe
Le Sphinx à tête de mort
Anglais : Death’s head hawkmoth; Allemand: Totenkopfschwärmer; Castillan: Esfinge de la muerta, calavera
Taxinomie
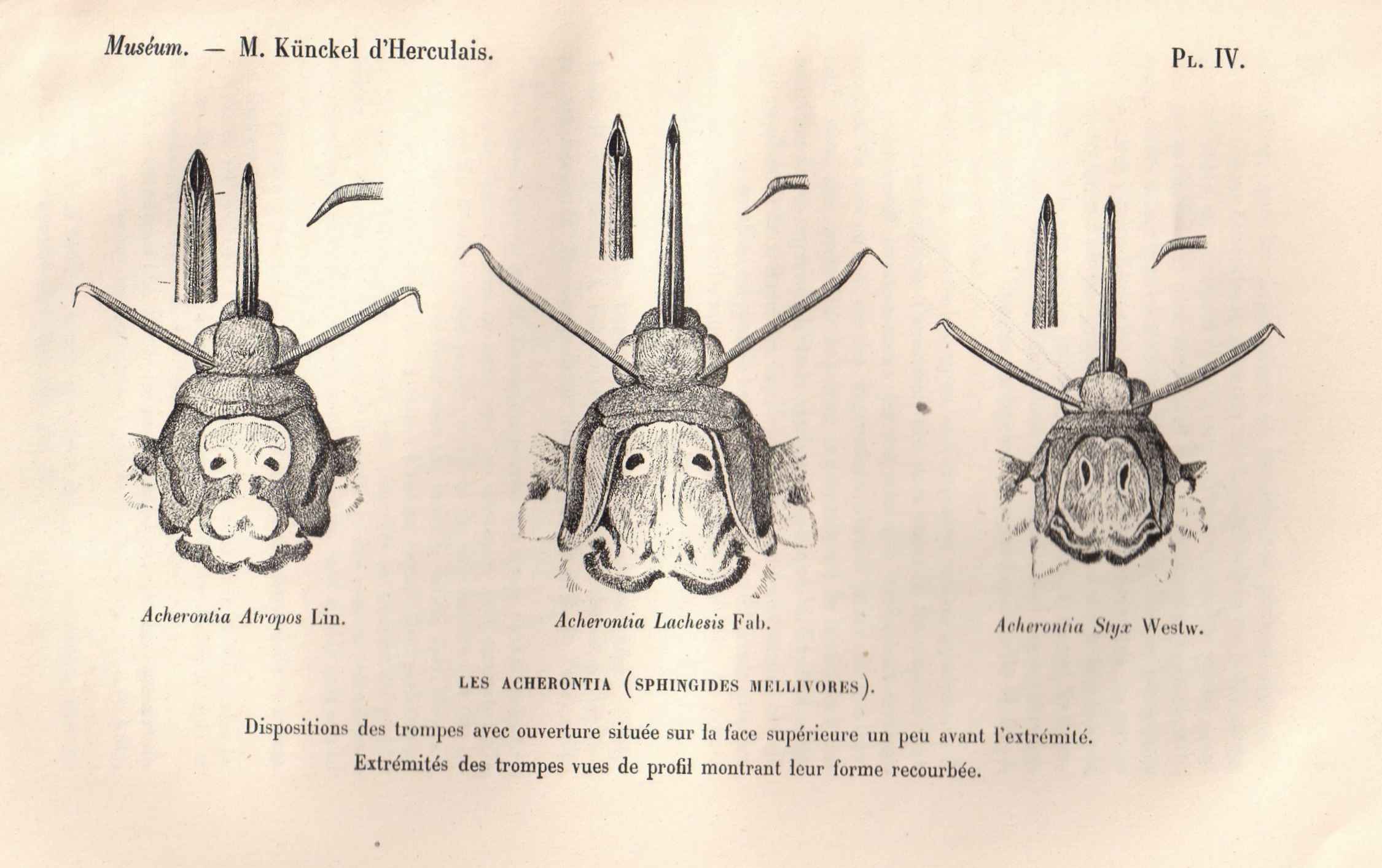
En France, l’espèce est inconfondable. Il existe dans le monde 2 autres espèces dans le genre Acherontia, toutes les 2 asiatiques: Acherontia lachesis (Fabricius, 1798) et Acherontia styx Westwood, 1847. Sur le montage ci-dessous, je présente les 3 espèces. Si atropos est franchement différent de lachesis, il n’en est pas de même de styx, et les séparer pose parfois problème.

Distribution
Monde: toute l’Afrique, Madagascar et la Réunion, toute la Péninsule Arabique, remontant au nord par l’Iran, l’est du Turkménistan, de l’Ouzbékistan, et du Kazakhstan, jusqu’à la Russie, atteignant le sud de la Finlande, de la Suède et de la Norvège. L’insecte est également connu en Islande.
France: partout, mais plus fréquent dans la moitié sud. Il est toutefois possible de le rencontrer dans tous les départements.
Plantes-hôtes
Surtout Solanaceae (Solanum sp., Datura sp., Lycium barbarum, Nicotiana tabacum) mais aussi Oleaceae (Jasminum, Ligustrum, Olea et Fraxinus), Buddlejaceae (surtout Buddleja davidii) et Celastraceae (Euonymus europeus). Beaucoup d’autres plantes mineures signalées (Pittaway, 1995:)
Le plus grand Sphingidae européen, avec une envergure atteignant 130 mm, comme certains Agrius convolvuli. Toutefois, A. atropos est une espèce plus massive, au corps lourd et au thorax puissant. Ce thorax est orné d’un motif évoquant de façon saisissante un crâne humain. L’espèce n’est pas commune en France, venant assez rarement au piégeage lumineux. On voit parfois l’adulte en mai et juin, ce qui correspond aux premiers migrants venant d’Afrique. J’ai eu le loisir d’en collecter un mâle au mois de juin à plus de 1800 m dans les Pyrénées (col de Mantet), ce qui est particulièrement rare. Il est nettement plus fréquent d’en trouver sa splendide chenille en juillet-août, le plus souvent sur des Solanaceae sauvages ou cultivées. Lorsque les pieds de pommes de terre n’étaient pas couverts de pesticides, cette chenille était assez régulière, et dans le village de Vatan (Indre) où j’ai passé mon enfance, les agriculteurs me mettaient souvent de côté son énorme chrysalide, déterrée au moment de la récolte des tubercules. En fait, cette chenille accepte en captivité une multitude de plantes, surtout des Oleaceae (Ligustrum, Olea, Fraxinus) mais aussi des Verbenaceae, Apocynaceae… Je l’ai trouvé chez moi (Laplume, 47) mangeant les feuilles d’un Buddleja ornemental.
Elle présente trois formes de coloration, la plus classique étant jaune d’or avec des chevrons bleutés, mais il existe aussi une forme plus cryptique, brun sombre et beige ainsi qu’une très rare forme verte. Je n’ai personnellement jamais vu cette dernière forme, mais vient d’en recevoir un splendide cliché (chenille trouvée adulte sur Datura stramonium) pris par Samuel Vienne à Canet en Rousillon (66) le 21 octobre 2017.
L’élevage de l’insecte est très aisé, la chenille consommant toutes les espèces de Ligustrum (ce qui permet des élevages d’hiver). J’ai vu des clichés de chenilles d’atropos nourries avec des fines tranches de tubercules de pomme de terre! C’est aussi une espèce souvent élevée sur aliments artificiels. L’accouplement est aisé, et les pontes s’étendent sur plus d’une semaine si on alimente la femelle convenablement.
La chrysalide est enterrée à grande profondeur, elle est brune luisante et très mobile. Elle réalise une loge dépassant les 10 cm dans laquelle elle séjourne en moyenne 5 semaines produisant des imagos de deuxième génération stériles qui volent de la fin août à la mi-octobre. A. atropos ne se reproduit donc pas sous nos latitudes.
Il est plus fréquent d’attirer aux lampes ces insectes de deuxième génération que les migrants de printemps. A. atropos vole surtout dans la moitié sud de la France, mais les années chaudes il remonte jusqu’au niveau de la Norvège et de l’Islande.
Cette espèce a la particularité d’émettre des sons stridents en propulsant de l’air hors du pharynx par la trompe. L’origine de ce son a fait l’objet de multiples hypothèses, souvent totalement farfelues, et c’est finalement l’étude très complète de Busnel & Dumotier (1959) qui élucide le mystère. Ces auteurs démontrent, dissection à l’appui, que le papillon possède un épipharynx modifié qui lui permet par propulsion d’air, d’émettre un duo de deux sons de fréquences différentes. Les fréquences exactes du « cri » du sphinx à tête de mort ont par la suite été analysées par Brehm & al, 2015.
L’insecte possède une trompe particulièrement courte et aiguë qui lui sert surtout à perforer les alvéoles des ruches pour en consommer le miel. Il semble pouvoir pénétrer dans les ruches en quasi impunité, s’aidant d’un camouflage chimique. Selon Moritz, 1991, il devient chimiquement invisible grâce à des hydrocarbures cuticulaires qui miment ceux présents sur les abeilles elles-mêmes.
Selon Pittaway (1993, 82) l’insecte butine aussi les fleurs de pomme de terre et de tabac. Je ne l’ai jamais observé dans cette activité et m’interroge vraiment sur la possibilité pour cet insecte d’utiliser une trompe aussi particulière pour ponctionner du nectar.
Cette possibilité d’émettre des sons jointe au motif si particulier qui orne le thorax de l’adulte a longtemps conféré au Sphinx à tête de mort une réputation funeste, et on pensait autrefois que son entrée dans une maison était le signe avant-coureur d’un décès imminent. A noter que le papillon émet ces sons avant son émergence, lorsqu’il est bien formé dans sa chrysalide, soit à partir de 5 jours avant son éclosion.
<- Hippotion celerio Agrius convolvuli ->




