

Sphinx maurorum (Jordan, 1931). (Jordan, 1931)
Hyloicus pinastri maurorum Jordan, 1931, Novit. zool. 36: 243.
Localité type : Hammam R’Irha, Algerie.
Le Sphinx mauresque
Nom vernaculaire hors France
Anglais: Southern Pine Hawkmoth
Taxinomie
Voir texte ci-dessous
Distribution
Monde: Montagne du Rif et de l’Atlas en Afrique du nord, toute la péninsule ibérique et Corse.
France: La carte n’est pas stabilisée, au regard des confusions fréquentes avec l’espèce pinastri. Il semblerait toutefois que les deux espèces soient complémentaires, avec une mince frange de cohabitation/hybridation (voir ci-dessous).
Plantes-hôtes
Toutes les espèces du genre Pinus semblent acceptées, avec dans le sud de la France une préférence pour Pinus sylvestris et Pinus pinaster. Egalement donné de Cedrus sp. (Pittaway 1993: 88).
Pour bien comprendre la séparation des deux taxons S. pinastri et S. maurorum, il nous parait utile de présenter ici une partie de l’article publié dans la Revue OREINA n°5, mai 2009 pp 17-22.
Historique du groupe
Sphinx pinastri fut décrit par Linné en 1758 dans la célèbre 10ème édition de son Système Naturel. La localité-type n’est pas précisée, mais il est probable que l’auteur se soit basé sur des exemplaires du nord de l’Europe pour sa description.
En 1931, un premier article de Karl Jordan souligne l’étonnante variabilité de l’armature génitale mâle de l’insecte que nous appelons le Sphinx du pin (the pine hawkmoth, der Kiefernschwärmer). Par manque visible de matériel, cette note ne clarifie pas totalement la situation mais présente l’immense avantage de poser le problème. Jordan éclate l’espèce pinastri en trois groupes renfermant sept sous-espèces, dont cinq sont alors décrites.

Le premier groupe renferme les sous-espèces dont les deux processus du sacculus sont d’égale longueur. Dans ce groupe, il place les sous-espèces morio (Rothschild & Jordan, 1903) du Japon et arestus (Jordan, 1931) qu’il décrit de l’Ussuri (région couramment appelée le « Far East »)
Le second groupe est composé des sous-espèces dont les deux processus du sacculus sont d’inégale longueur, le dorsal beaucoup plus long, plus fin, sub-cylindrique dans sa moitié distale, et généralement recourbé vers le bas. Le processus ventral est plus large et spatulé. Ce groupe renferme la sous-espèce nominative pinastri (Linnaeus, 1758), qui vole en Europe du nord et de l’est (jusqu’en Sibérie), cenisius (Jordan, 1931) décrite des Hautes Alpes (La Grave), medialis (Jordan, 1931) du centre de la France.
Le troisième groupe est composé des sous-espèces dont les deux processus sont aplatis, le dorsal étant triangulaire et dentelé, le ventral plus court et spatulé. La différence entre ces armatures et celles du second groupe est saisissante. Jordan décrit dans ce groupe deux sous-espèces : massiliensis (Jordan, 1931) de Marseille et de Sainte Baume (Bouche du Rhône) et maurorum (Jordan, 1931) des Pyrénées françaises (Luchon, Cauterets), d’Espagne (San Ildefonso, Segovia) et d’Algérie (Hammam R’Irha, Mt Zaccar, Oran, (localité type)).
Kernbach (1969) simplifie considérablement ces conclusions. Dans un article paru après sa mort intitulé « Die Sphingidengattung Sphinx Linné » il énumère les espèces de ce genre décrites à l’échelle mondiale. Son traitement du complexe pinastri s’éloigne fortement de celui de Jordan : il n’y a qu’une espèce, pinastri, avec trois sous-espèces, pinastri, morio et arestus. Toutes les autres sous-espèces de Jordan sont placées en synonymie de p. pinastri. Il analyse les différences génitales illustrées par Jordan et conclu à une très grande variabilité individuelle sans entrevoir la distribution spatiale de ces variations.
Rougeot & Viette (1978 : 181), s’ils ne reconnaissent ni massiliensis, cenisius ou medialis, traitent maurorum comme la sous-espèce de pinastri d’Espagne et d’Afrique du nord. Curieusement ils omettent de parler des exemplaires pyrénéens dont parlait Jordan et n’incluent donc pas maurorum dans la faune de France. Tous les critères qu’ils donnent pour séparer les deux sous-espèces pinastri et maurorum (taille plus petite, coloration plus uniforme, dessins moins nets) sont inutilisables et/ou faux.
Derzhavets (1979) modifie le statut de la sous-espèce morio, qu’il rehausse au rang de bonne espèce avec deux sous-espèces, morio au Japon et arestus en Russie centrale et de l’est, Mongolie, nord-est de la Chine et Corée du sud. Les différences génitales invoquées par Jordan sont soulignées et approuvées. Sphinx pinastri laricis décrit par Rozhkov en 1946 de l’est de la Sibérie est fort logiquement placé par Derzhavets en synonymie de morio arestus. Dans le même papier cet auteur décrit une nouvelle sous espèce de S. pinastri de Georgie, qu’il nomme euxinus. Par la suite, les observations de Litvinchuk (1986 : 134) corroborent le statut de bonne espèce de morio. Cet auteur étudie l’influence de la température et de l’horaire sur l’activité reproductrice de Sphinx morio. Il note que morio est actif au petit matin, contrairement à pinastri qui vole et s’accouple entre 22h et 1h. Un tel mécanisme peux être responsable de l’isolation de ces deux taxa, on trouve des cas similaires chez les Hyles.
La sous espèce maurorum est restaurée de façon totalement implicite par Freina & Witt (1987) dans le splendide Die Bombyces und Sphinges der Westpalearktis, 1. Ces auteurs ne donnent pas de raison à cette action, il est probable qu’ils ignoraient tout simplement le travail de Kernbach cité ci-dessus.
Eitschberger, Danner & Surholt (1990) réhaussent maurorum au statut d’espèce sans donner de raison à cette action. Ce taxon est donc sorti de la synonymie en deux étapes, sous-espèce puis espèce sans que jamais il n’y ait eu de justification.
Pittaway, dans son ouvrage sur les Sphingidae de l’ouest paléarctique (1993 : 86-89) le rétrograde au statut subspécifique, en raison de la présence de nombreuses formes intermédiaires (hybrides présumés) dans les zones de contact entre pinastri et maurorum (principalement le sud-est de la France).
Danner, Eitschberger & Surholt, dans leur ouvrage Die Schwärmer der westlichen Palaearktis (1998 : 52-55) revalident à nouveau l’espèce maurorum, appuyant cette fois ci leur action sur les critères génitaux signalés par Jordan mais également sur l’habitus des chenilles. Nous reviendrons sur tous les points qu’ils évoquent.
Il semble donc admis dans la littérature que nous avons bien affaire à deux espèces séparées. Ayant eu l’occasion de consulter les types de maurorum, massiliensis, medialis et cenisius au NHM de Londres, je suis arrivé à la conclusion que medialis était conspécifique de pinastri dont il ne constitue qu’une infime variation (au même titre que l’euxinus de Derzhavets) tandis que maurorum est une espèce bien tranchée par des critères génitaux de très grande ampleur. Le taxon massiliensis me semblait constituer la population hybride, zone de contact entre les maurorum du sud et les pinastri nordiques. L’analyse ADN (séquençage du gène mitochondriale CO1) place nos exemplaires avec maurorum ce qui laisserait entendre que si ces exemplaires sont bien des hybrides, la femelle pondeuse appartenait au taxon maurorum. En effet les mitochondries sont apportées par l’ovule donc la mère. Nous traiterons comme la majorité des auteurs massiliensis comme synonyme de maurorum. Plus délicat est le statut de la sous-espèce medialis que Jordan avait décrit du centre de la France sur quatre insectes provenant de la collection Sand. Ces spécimens ne portaient pas d’étiquette de localité, et quand on sait le nombre de citations erronées liées à l’utilisation de la collection Sand, on peut fortement douter de leur origine. Jordan figure les génitalia de deux de ces exemplaires, l’un pouvant être maurorum, l’autre (le type) pinastri. Dans l’attente d’investigations plus poussées, nous maintenons medialis en synonymie de pinastri.
Les premiers stades de pinastri et maurorum sont statistiquement différents. Toutefois, de très récentes observations montrent que séparer maurorum de pinastri sur la seule base des stades larvaires est un challenge dangereux. Même si je pensais réellement avoir trouvé de bons critères, ils ne sont visiblement pas fiables à 100%. Par contre, l’analyse par séquençage du gêne CO1 nous a parfaitement scindé les exemplaires de ma collection en deux groupes, ce qui est à la fois encourageant pour les conclusions du présent article et pour la fiabilité de l’outil.
Les différences entre les deux espèces pinastri et maurorum.
Différences sur l’armature génitale du mâle.
C’est sur les valves que se situe la différence la plus frappante. Le sacculus se divise en deux branches : une branche dorsale, une branche ventrale.
Chez Sphinx pinastri, la branche dorsale du sacculus est plus longue que la ventrale, généralement courbée vers le bas, presque toujours cylindrique dans sa moitié apicale. Cette branche est toujours extrêmement effilée et est généralement totalement lisse.
Sphinx maurorum présente une branche ventrale arrondie, plutôt courte (1/4 de la valve). La branche dorsale est triangulaire avec des bords dentelés, à pointe orientée le plus souvent vers le haut. Cette branche est généralement courte, au mieux atteint t-elle la moitié de la harpe. Parfois, cette branche est recourbée vers le bas, tendant vers le type pinastri, mais elle est toujours plus courte, rugueuse voir dentelée sur sa face inférieure. Les exemplaires volant de la Gironde aux Pyrénées orientales sont sans ambiguïté, avec des genitaliae du type de celle de notre figure ci dessous (au centre). Par contre, dans l’est de la France et en particulier dans le Var, les basses et hautes Alpes, on trouve des exemplaires plus délicats à déterminer mais avec un peu d’habitude, et en utilisant les critères ci-dessus, on arrive à un diagnostic presque certain.
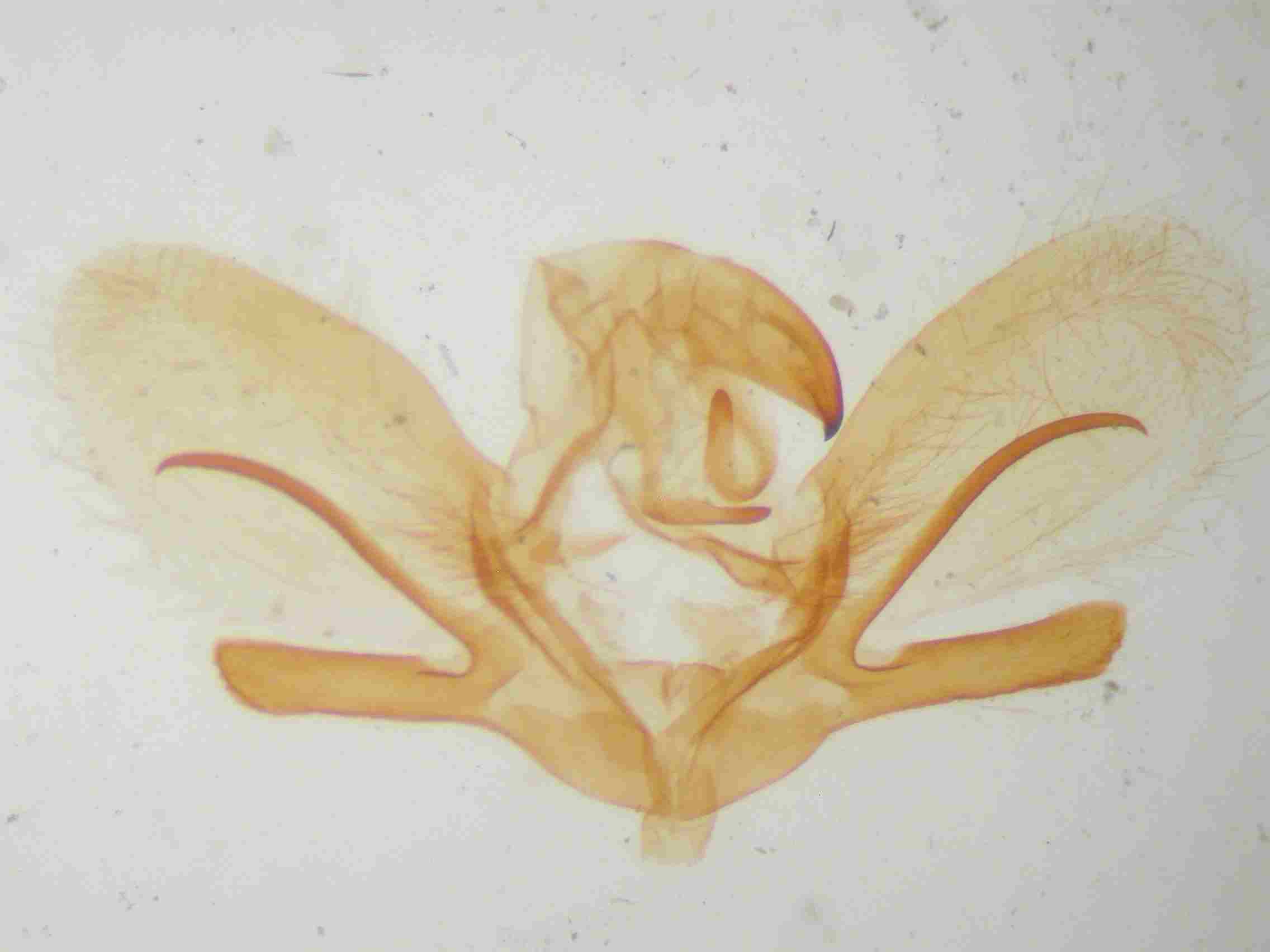
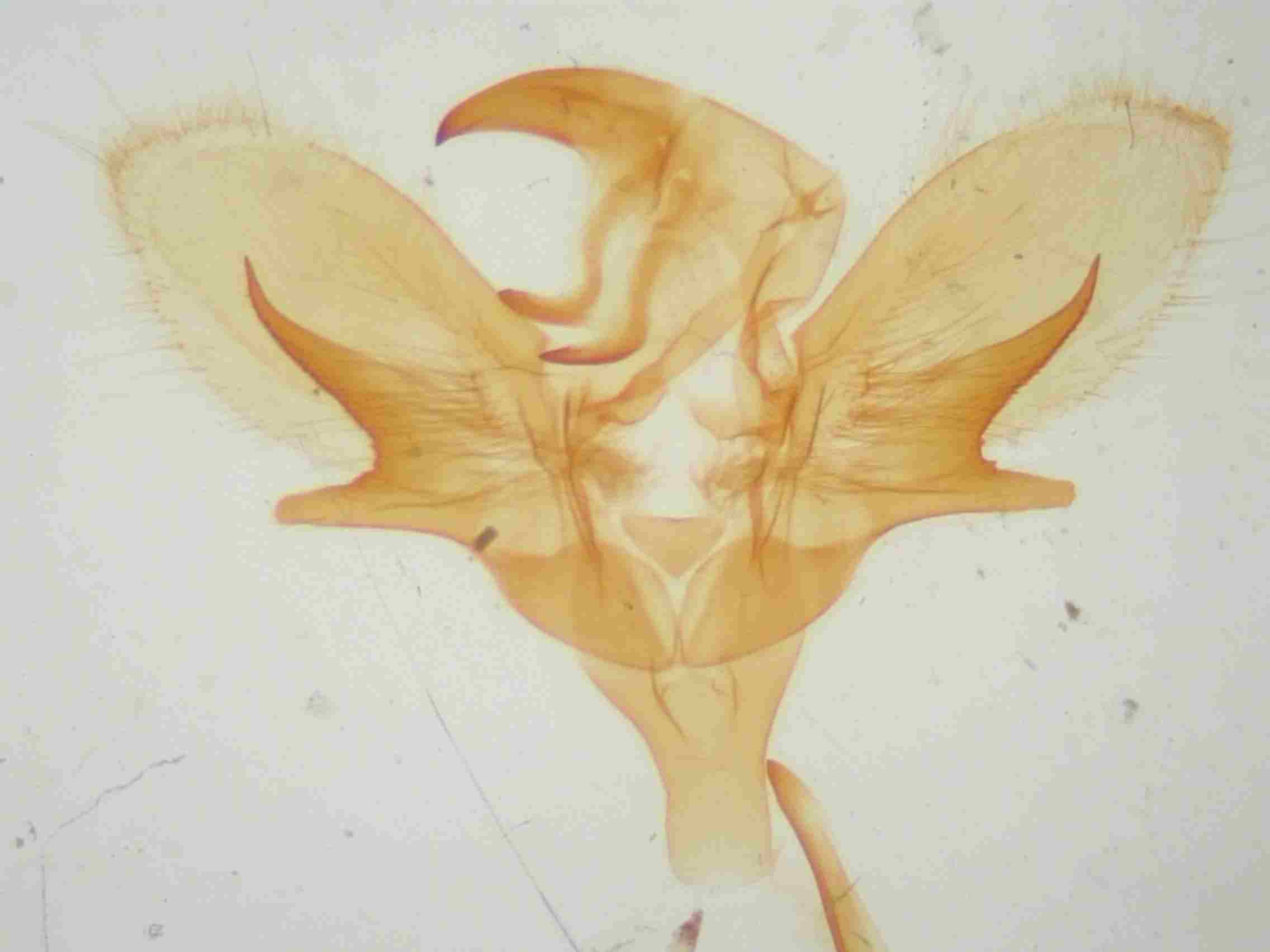
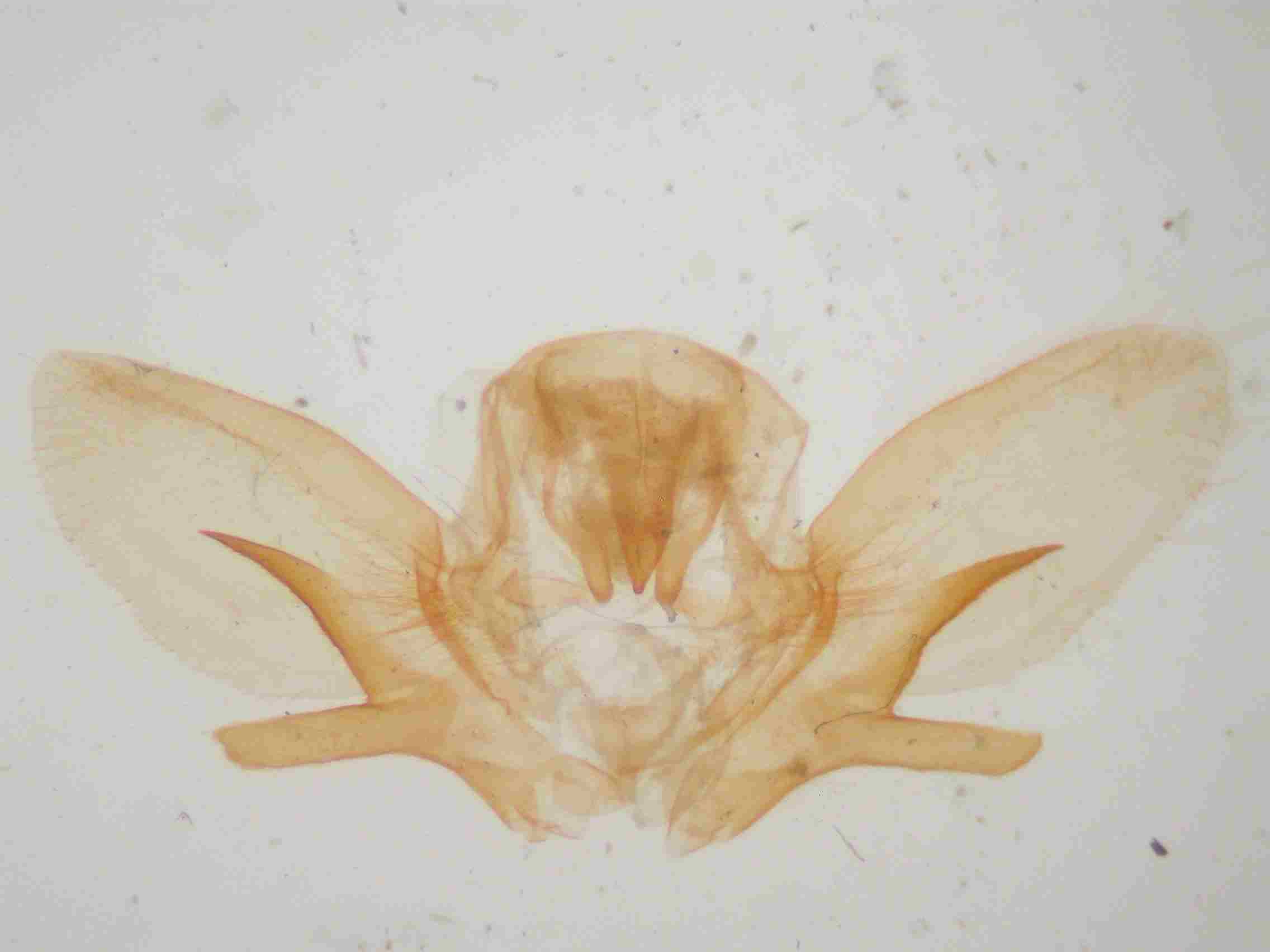
Armatures génitales mâles de Sphinx pinatri (à gauche), maurorum (au centre) et présumé hybride pinastri x maurorum (à droite) © Jean Haxaire.
.
Différences d’habitus
Chez l’imago :
Au niveau de l’habitus, la majorité des critères que j’avais noté permettant de séparer avec certitude les deux espèces maurorum et pinastri n’ont pas résisté à l’analyse systématique. La planche ci dessous donne une idée du problème. 
Habitus des imagos, à gauche Sphinx pinastri (3 mâles et deux femelles), à droite Sphinx maurorum (3 mâles et 3 femelles) © Jean Haxaire
On peut toutefois noter que statistiquement pinastri est un insecte plus arrondi, moins élancé, d’un gris plus pâle avec un motif plus contrasté sur les ailes antérieures. A l’inverse, maurorum est plus élancé, gris plus sombre et de motif peu apparent. Cela est visible sur les exemplaires figurant sur notre planche (fig 1), mais on trouve parfois des exemplaires qui vont à l’inverse de cette tendance. Aussi l’hypothèse d’une influence environnementale n’est pas exclue. En effet, la majorité des pinastri de ma collection proviennent de biotopes plutôt tempérés, soit alpins soit du nord ou l’est de la France, tandis que les maurorum sont de la moitié sud. Il sera instructif d’analyser les résultats d’élevages des deux espèces effectués dans des conditions de température et d’humidité bien différentes. On sait combien ces facteurs influent sur la taille et la coloration de beaucoup de Sphingidae, comme les Hyles et les Smerinthus.
Signalons que les deux espèces présentent des formes mélanisantes. Je n’ai jamais collecté le pinastri mélanisant, mais par contre j’ai attiré deux mâles de maurorum d’un noir velouté exceptionnel la même nuit dans la partie landaise du Lot & Garonne.


Habitus de Sphinx maurorum, forme typique (à gauche) et mélanisante (droite) © Jean Haxaire
On préférera donc à l’examen de l’habitus l’étude des pièces génitales. Et là, c’est d’une grande simplicité puisqu’il suffit de détacher une valve pour avoir la détermination pratiquement certaine. Personnellement j’extrais de façon systématique l’armature génitale des spécimens que je récolte, ce qui est particulièrement aisé sur des exemplaires frais. La détermination peut alors s’effectuer avec une simple loupe et les différences observées sont telles que même l’entomologiste peu familiarisé avec l’examen des genitalia peut parvenir à un bon diagnostic. Cela est particulièrement appréciable pour l’identification rapide de terrain. Je ne l’ai pas expérimenté, mais je pense qu’il est même possible de travailler sur un insecte vivant, sans le mutiler bien entendu (les mâles de Sphingidae ouvrent souvent spontanément les valves quand on les tiens retournés entre le pouce et l’index, aile replié sur le dos). Cela permettrait l’inventaire sans captures excessives.
Sur la chenille adulte :
Il est là encore difficile d’extrapoler sur quelques observations. J’ai du élever 5 souches de pinastri et 4 de maurorum. Toutes les pontes élevées provenaient de femelles sauvages, je ne parle évidemment pas des 2ème et 3ème générations obtenues en captivité. J’ai observées sur mes élevages des différences nettes, mais toute la question est de savoir si mes observations sont reproductibles.
Les quatre premiers stades sont absolument identiques et je ne les décrirai pas, cela a été fait dans de nombreux ouvrages.
C’est au dernier stade que la différence est notable. Sphinx maurorum ne présente pratiquement jamais la belle chenille au flancs verts lignés de jaune que nous connaissons bien mais une bête plus fine, plus longue, d’une couleur le plus souvent beige pâle avec des reflets fauves sur le dos. D’autres, totalement dépourvues de ce type de reflets, étaient franchement grises. Dans tous les cas, les chenilles sont finement lignées transversalement de noir. Les stigmates sont noirs ou oranges, ce critère n’est donc pas, comme le disent Danner & al. (1999 : 55) un bon caractère diagnostic.
Dans la mesure où l’ouvrage fort onéreux de ces auteurs est assez peu distribué, je propose ci-dessous une traduction de leur tableau comparatif.
| Hyloicus pinastri | Hyloicus maurorum | |
| 1.-4. Habitus
5. Habitus chenille
Forme verte |
pas de différences reconnaissables.
bande dorsale brune, par ailleurs corps entier vert avec bande longitudinale blanche ; |
pas de différences reconnaissables.
dans l’élevage personnel aucune forme verte n’est apparue. |
| Stigma* | rouge vif avec bord noir. | noir profond. |
| Couleur de base
(forme brune) dorsale et subdorsale : |
clair, moyen ou brun foncé. latérale : brun. ventrale : brun foncé à brun gris. |
gris-brun avec différents tons de jaune. latérale et ventrale : clair, gris, gris-beige. individuellement plus de coloration. moins brune, partiellement teintée de bleu. |
| Bande subdorsale inférieure | Toujours blanche. | Blanc plus pâle, le blanc est teinté. |
| Ligne latérale inférieure | Blanche, plus rarement légèrement teintée. | Blanc plus pâle, également blanc-jaunâtre. |
| Impression générale | Brun plus sombre et plus uniforme, plus contrasté, teintes bien délimitées. | Gris plus clair, couleurs plus interpénétrantes. |
*critère non valable, comme on peut le constater sur les clichés ci-dessous.
Je lance donc un appel à tous les chasseurs de nuit, faites pondre les femelles de ce groupe, et élevez au moins dix œufs par ponte. Ce n’est que de cette façon que l’on saura si réellement les larves diffèrent autant que je le pense. Je n’ai trouvé qu’une seule fois la forme verte de la chenille de maurorum dans les Alpes (fig 11). Dans le Lot & Garonne et la Haute Garonne, toutes les chenilles trouvées in natura ou obtenues ab ovo étaient brunes ou grises
Sphinx maurorum en France
Dans la littérature, maurorum est donnée traditionnellement d’Afrique du nord, régions montagneuses de l’Atlas et du Rif (d’où le nom de l’insecte) et de la péninsule ibérique. La présence de l’insecte en France n’est documentée que par les travaux de Jordan (1931 : 248) avec les deux stations pyrénéennes citées ci-dessus (Luchon, Cauterets). L’insecte est depuis totalement passé sous silence. Même Danner, Eitschberger & Surholt (1998 : 53) reconnaissent dans leur énorme ouvrage sur les Sphingidae paléarctique n’avoir aucune donnée française autre que la description originale.
Lorsqu’en 1999 je me suis penché sur le problème de la détermination des supposés pinastri de ma collection (sous l’impulsion de mon collègue et ami Tony Pittaway qui voulait actualiser son site Internet) j’ai eu la surprise de constater que 80% de mes exemplaires appartenaient en fait à l’espèce maurorum, qui remontait beaucoup plus au nord que ce que nous supposions tous. Ces résultats sont forcément biaisés par le fait que je vis dans le sud-ouest de la France mais j’ai assez régulièrement collecté les insectes de ce groupe lors de mes chasses de nuit dans la région centre, dans le nord et l’est de la France.
Des départements de la Gironde, des Landes, du Lot et Garonne, du Lot, de la Corrèze, de la Haute-Garonne, de l’Aude et des Pyrénées Orientales, je ne connais que maurorum. L’insecte vole à partir de la mi avril, mais est vraiment fréquent dans le Lot & Garonne de la deuxième semaine de juin à la mi-juillet et produit une seconde génération partielle à partir de la mi-août. Il vient en général aux lampes de la tombée de la nuit à une heure du matin. Il semble consommer la majorité des pins locaux, en particulier Pinus maritima et Pinus sylvestris. Pour l’Espagne Gomez Bustillo & Ribio citent une gamme de plantes hôtes beaucoup plus étendues englobant non seulement la majorité des Pinus espagnol mais aussi Abies pectinata, Larix decidua, Picea abies et Cedrus sp. Pour notre part nous n’avons jamais trouvé une chenille de maurorum sur un autre genre que le genre Pinus.
Selon Pittaway, maurorum est en phase d’expansion vers le nord de la France, et cet auteur considère que la situation a évolué depuis une vingtaine d’année. Cette spéculation mérite d’être vérifiée par la dissection des spécimens provenant d’anciennes collectes dans la moitié sud de la France. Dans la mesure où personne n’est capable de reconnaître un pinastri d’un maurorum sur l’habitus, il est impossible de se fier à la moindre citation. Encore maintenant, la majorité des entomologistes qui collectent un exemplaire du groupe en France le nomme pinastri.
Tony Pittaway suppose que dans l’ouest paléarctique, l’espèce ancestrale se serait scindée en deux populations qui auraient évoluées séparément l’une de l’autre et donc divergées jusqu’à la fin de la dernière glaciation où l’isolat maurorum, en condition plus favorable, aurait débuté sa remontée vers le nord.
L’espèce, en admettant que le processus de spéciation soit achevé, serait donc en phase d’expansion et pourrait même repousser pinastri vers le nord. Nous avons disséqué, Jean Michel Bompar et moi-même des exemplaires curieux provenant des environs immédiats de Toulon, et trouvé des genitalia semblables à ce que Jordan avait baptisé massiliensis (sous-espèce des Bouches du Rhône). Nous pensons être là au niveau d’une zone de contact entre les deux populations avec création d’une bande d’individus hybrides et probablement fertiles. Cette fine zone d’hybridation pourrait remettre en cause le statut d’espèce de maurorum mais désormais le critère d’interfécondité pour définir l’appartenance à une même espèce n’est plus aussi dogmatique et souffre de nombreuses exceptions.
Selon Stebbins (1950) qui résume les approches de Huxley (1938), Dobzansky (1941) et Mayr (1942), « les espèces consistent en systèmes de populations séparées les unes des autres par des discontinuités complètes ou très grandes dans leur variation. Ces discontinuités doivent avoir une base génétique et refléter l’existence de mécanismes isolateurs qui empêchent totalement ou presque le transfert de gènes d’un système de population à un autre ». Le « presque » est en soit déjà gênant, mais depuis cette date, la majorité des auteurs reconnaissent que le concept biologique de l’espèce ne s’applique qu’à une minorité de populations géographiquement contiguës. Si l’on admet que la rencontre entre pinastri et maurorum est récente (ce que je crois) et que maurorum est en phase d’expansion (ce que je soupçonne fortement) alors rien ne s’oppose plus à la validité de ces deux espèces.
En effet, il existe de bonnes espèces, indiscutables pour lesquels le concept d’isolement n’est pas vérifié. Ainsi les loups et les coyotes produisent une descendance fertile, et il ne fait aucun doute qu’il s’agisse de deux espèces distinctes. Pour revenir aux Sphingidae, Hyles tithymali et Hyles euphorbiae s’hybrident et produisent également une descendance fertile. Kitching et Cadiou (2000 : 168) admettent le statut spécifique de maurorum sur le fait que la zone d’hybridation est étroite et stable (Ce point demeure encore à démontrer). La majorité des auteurs traitant du concept d’espèce s’accordent à retenir huit barrières d’isolement des espèces empêchant l’accouplement et/ou l’obtention d’une descendance viable et fertiles (barrières prézygotique et postzygotique). Visiblement pinastri et maurorum n’en ont aucune, ce qui encore une fois provient probablement du fait qu’il s’agit d’espèces allopatriques très récemment entrées en contact.
Les différences génitales entre les deux entités semblent largement suffisantes pour considérer que nous avons là affaire à deux bonnes espèces. C’est désormais l’avis de la majorité des auteurs (Pittaway, Eitschberger, Kitching & Cadiou).
Nous avons très récemment intégré une série de nos exemplaires de pinastri et de maurorum au programme BoLD (Barcoding of Life Diversity). Ce programme qui repose sur le séquençage du gène mitochondrial CO1 (Cytochrome Oxydase 1) a révélé une séparation génétique parfaite entre les deux entités, isolées au préalable sur des critères génitaux. Cela nous montre que la dissection demeure le moyen le plus efficace et surtout le plus abordable pour séparer les deux taxa.
Les exemplaires du Var, du Vaucluse, des Hautes-Alpes et de l’Isère (zone de contact entre les deux espèces) posent quelques problèmes, et comme souligné plus haut, la détermination n’y est pas toujours aisée. Dans deux biotopes alpins Antoine Lévêque a obtenu les deux espèces qui volaient la même nuit. Toutefois, si l’on tient compte des caractères de la branche dorsale de la harpe, et en particulier de son aspect (lisse ou granuleux) on arrive à une détermination confortée à 100% par l’analyse génétique. Dans le sud ouest, la situation est sans ambiguïté dans tous les biotopes que j’ai personnellement visités. Je propose donc pour les deux espèces les cartes de répartition visibles sous l’onglet Cartographie qui ne demandent qu’à être complétées/modifiées.
Je finirais cette note sur un appel à contribution. Dans la mesure où ces insectes ne sont pas des raretés, je demande aux collègues motivés par l’étude de me faire parvenir au moins un exemplaire par biotope visité, si possible un mâle en papillote. Il sera disséqué, mais surtout intégré au programme BoLD et donc analysé génétiquement. Je suis également preneur de pontes de ces deux espèces quelque en soit l’origine. C’est de cette façon que nous serons en mesure de produire dans quelques années une carte de répartition plus complète.
Remerciements : Le Dr Ian J. Kitching m’a accueilli au NHM de Londres, autorisant l’examen des types de Jordan. Antoine Lévêque m’a remis ses recoltes de Sphingidae alpins. Daniel Herbin a bien voulu me récolter tous les S. maurorum qui venaient aux lampes UV disposées devant sa maison de Castanet Tolosan (31)
Que ces collaborateurs et amis trouvent ici l’expression de ma profonde gratitude.
Bibliographie :
Danner, F., Eitschberger, U., & Surholt, B. 1998.- Die Schwärmer der westlichen Palearktis. Bausteine zu einer Revision (Lepidoptera Sphingidae). Textband. Herbipoliana 4(1): 1-368. Tafelband. Herbipoliana 4(2): 1-720.
Derzhavets, Yu. A. 1979.- The range and geographic variation of the hawk-moth Hyloicus pinastri L. and H. morio Rothschild & Jordan., stat. n. (Lepidoptera, Sphingidae). Rev. Ent. Russ. 58: 112-115, Lenningrad (en russe).
Eitschberger, U., Danner, F. & Surholt, B. 1990.- Taxonomische Veränderungen bei den Sphingiden Europas und die Beschreibung einer neuen Laothoe-Unterart von der Iberischen Halbinsel (Lepidoptera, Sphingidae). Atalanta 20: 261-271, Würzburg.
Freina, J. J. De & Witt, Th. J. 1987.- Die Bombyces und Sphinges der Westpalaeaktis (Insecta Lepidoptera) Bd. 1.-Edition Forschung & Wissennschaft, München.
Jordan, K. 1931.- On the geographical variation of the pine hawk-moth, Hyloicus pinastri. Novit. Zool. XXXVI: 243-249.
Kernbach, K. 1969.- Die Sphingidengattung Sphinx Linnée (Lep. Sphingidae). Deutsch. Ent. Z. N. F., 16 (1-3): 91-114.
Litvinchuk, L. N. 1986.- Ethological observation to butterflies and larvae of learch sphinx- Hyloicus morio Rothsch. et Jord. (Lepidoptera Sphingidae) in pine forests attached to the Ob. Izv. sib. Otdel. Akad. Nauk SSSR, (Biol. Nauk) (6): 129-134 (en russe)
Pittaway, A. R. 1993.- The Hawkmoths of the Western Palaearctic. Harley Books, Colchester. 240 p. Plates A-H, 1-13.
Rougeot, P. C. & Viette, P. 1978.- Guide des papillons nocturnes d’Europe et d’Afrique du nord. Hétérocères (Partim), 228pp., 40 pls. Paris.
Rozhkov, A. S. 1946.- The pine hawk-moth (Sphinx pinastri L.), a pest of larch and stone pine in Cisbaikalia. Zool. Zhurn., 35 (12) : 1907-1908.
Rozhkov, A. S. 1972.- A new hawk-moth of the genus Sphinx (Lepidoptera Sphingidae). Zool. Zhurn., 51 (12) : 1892-1893.
<- Sphinx pinastri Mimas tiliae ->



















